|
|
БИОПЛЁНКА. ЧТО ЭТО ТАКОЕ? С.В. Мальцев, Г.Ш. Мансурова. Казанская государственная медицинская академия
20.11.2017 11:01
 В статье представлены данные литературы о биопленке — особой форме организации микрофлоры организма человека, роли микробных биопленок в возникновении и развитии многих распространенных заболеваний, причинах антибиотико резистентности при их лечении. What is biofilm? The article presents published data on the biofilm — a special form of organization of the microflora of the human body, the role of microbial biofilms in the genesis and development of many common diseases, the causes of antibiotic resistance in their treatment. ДАВНО: Вплоть до конца прошлого века микробиология развивалась главным образом на основе исследований чистых культур микроорганизмов. ВЧЕРА: В конце ХХ века сформировалось представление об особой форме организации микрофлоры организма человека — хорошо организованном взаимодействующем сообществе микроорганизмов, покрывающих поверхности кишечной стенки, других слизистых оболочек, кожи и зубов человека. СЕГОДНЯ: На сегодняшний день известно, что большинство бактерий существуют в природе не в виде свободно плавающих клеток, а в виде специфически организованных биопленок (Biofilms). Причем сами бактерии составляют лишь 5-35% массы биопленки, остальная часть — это межбактериальный матрикс.
УСТОЙЧИВОСТЬ БИОПЛЁНОКТакая форма существования предоставляет бактериям массу преимуществ в условиях воздействия неблагоприятных факторов внешней среды и организма-хозяина. Микрофлора биопленки более устойчива к воздействию неблагоприятных факторов физической, химической и биологической природы по сравнению со свободно плавающими бактериями — они оказались очень устойчивы к воздействию ультрафиолетового излучения, дегидратации и вирусам, антибиотикам и факторам иммунной защиты [1, 3]. Фактором устойчивости биопленок оказывается слизисто-полимерный слой, вырабатываемый сразу после адгезии, и включающий липополисахариды, протеогликаны, гликопротеиды, эндополисахариды, аналогичные веществу клеточной стенки, гликокаликса и капсул бактерий. Примером защитной функции полимерной пленки является выживание Salmonella при хлорировании, что доказывает устойчивость биопленки к данному способу дезинфекции. РАСПРОСТРАНЁННОСТЬ БИОПЛЁНОК В природе биопленки распространены повсеместно. Формирование биопленок отмечено у большинства бактерий в природных, клинических и промышленных условиях. Они образуются в условиях текучести на границе двух средовых фаз (жидкость — жидкость, жидкость — воздух и т.д.). Биопленки обнаруживаются на твердых субстратах, погруженных в водный раствор, а также могут создавать плавающие маты на жидких поверхностях. Классическим примером биопленки может служить тонкое наслоение на скалах, находящихся посреди течения.
При достаточных ресурсах для роста биопленки быстро растут до макроскопических размеров. В биопленках может содержаться множество различных видов микроорганизмов, например, бактерии, простейшие, грибы и водоросли, каждый из группы выполняет специализированные метаболические функции [2, 4, 5]. Watnick P. и Kolter R. справедливо называют биопленки городами микробов [1].
БИОПЛЁНКА - СООБЩЕСТВО МИКРОБОВ Современная биотехнология позволяет успешно использовать оптимальное сообщество микроорганизмов для выполнения определенных функций. Это актуально в производстве пищевых продуктов, лекарств и пищевых добавок, утилизации разного рода отходов, нейтрализации загрязнений воды и почвы нефтепродуктами. Такие сообщества называют иногда консорциумами микроорганизмов. Практика показала многократное увеличение эффективности работы микроорганизмов при такой организации. Биопленка — сообщество микробов, которые прикреплены к поверхности или друг к другу, заключены в матрикс синтезированных ими внеклеточных полимерных веществ, имеют измененный фенотип, проявляющийся другими параметрами роста и экспрессии специфичных генов [6]. Это определение позволяет отличить микробные сообщества биопленок от похожих на них лишь внешне структур, например, колонии бактерий, растущих на поверхности агара, которые не проявляют ни одной из характеристик, свойственных истинной биопленке. Важно отметить, что бактерии, включенные в матрикс фрагментов, которые отрываются от биопленок на колонизированном медицинском устройстве и циркулируют в жидкостях тела, устойчиво проявляют все фенотипические характеристики исходной биопленки.
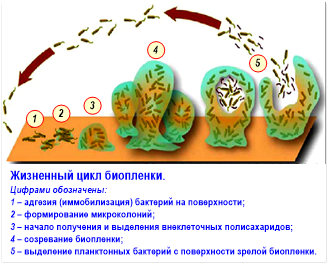
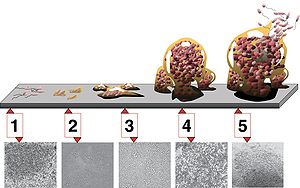
СТАДИИ РАЗВИТИЯ БИОПЛЁНКИ Выделяют пять стадий развития биопленки (рис.1): 1. Сначала происходит первичное прикрепление микроорганизмов к поверхности (адгезия, сорбция) из окружающей среды (обычно жидкости). Эта стадия обратима. 2. Окончательное (необратимое) прикрепление, иначе называемое фиксацией. На этой стадии микробы выделяют внеклеточные полимеры, обеспечивающие прочную адгезию. 3. Созревание (в англоязычной литературе — созревание-I). Клетки, прикрепившиеся к поверхности, облегчают прикрепление последующих клеток, внеклеточный матрикс удерживает вместе всю колонию. Накапливаются питательные вещества, клетки начинают делиться. 4. Рост (в англоязычной литературе — созревание-II). Образована зрелая биопленка, и теперь она изменяет свой размер и форму. Внеклеточный матрикс служит защитой клеток от внешних угроз. 5. Дисперсия (выброс бактерий): в результате деления периодически от биопленки отрываются отдельные клетки, способные через некоторое время прикрепиться к поверхности и образовать новую колонию. Рисунок 1. Стадии развития биопленки (копия из Wikipedia)
ОСНОВНЫЕ СВОЙСТВА БИОПЛЁНКИ Основные свойства биопленки: — взаимодействующая общность разных типов микроорганизмов; — микроорганизмы собраны в микроколонии; — микроколонии окружены защитным матриксом; — внутри микроколоний — различная среда; — микроорганизмы имеют примитивную систему связи; — микроорганизмы в биопленке устойчивы к антибиотикам, антимикробным средствам и реакции организма хозяина. РОЛЬ МИКРОБНЫХ БИОПЛЁНОКК настоящему времени достоверно доказана роль микробных биопленок в возникновении и развитии таких распространенных заболеваний, как :
Все эти заболевания трудны для лечения, имеют высокую частоту рецидивов и некоторые из них могут явиться причиной летальных исходов. Далеко не до конца ясны механизмы, по которым микроорганизмы, образующие биопленки, вызывают патологические процессы в макроорганизме. Кроме тканей организма хозяина, микробные биопленки колонизируют различные медицинские устройства небиологической природы, внедряемые в организм человека :
Исследования имплантированных медицинских устройств с применением электронной микроскопии показали присутствие бактериальных биопленок. ЕСЛИ ОБНАРУЖЕНА БИОПЛЁНКА У ПАЦИЕНТАВажно учитывать при подозрении на формирование биопленки у пациента: 1. отслоение биопленок в кровотоке или мочевыводящем тракте может приводить к формированию эмболов; 2. бактерии в биопленках могут обмениваться плазмидами резистентности (передача резистентности от вида к виду); 3. биопленки могут снижать чувствительность бактерий к антимикробным агентам 4. биопленки с гр. отриц. бактериями могут продуцировать эндотоксин, что может приводить к инфекционно-токсическому шоку; 5. бактерии в биопленке не поддаются воздействию иммунной системы хозяина. СОЦИАЛЬНОЕ ПОВЕДЕНИЕ МИКРООРГАНИЗМОВ Многочисленные физиологические процессы, происходящие в биопленке, отличаются от физиологии чистых культур этих же бактерий. Соответственно, реакция микроорганизмов на изменение условий окружающей среды в биопленке существенно отличается от реакции каждого отдельного вида в монокультуре. Такая организация обеспечивает ее физиологическую и функциональную стабильность и является основой конкурентного выживания в экологической нише. Сообщество микроорганизмов организует единую генетическую систему в виде плазмид — кольцевых ДНК, несущих поведенческий код для членов биопленки, определяющих их пищевые (трофические), энергетические и другие связи между собой и внешним миром [2]. Последнее получило специальное определение как социальное поведение микроорганизмов — Qvorum sensis [1, 5]. Феномен коллективного поведения бактерий впервые был описан около 20 лет назад, однако функции и роль системы Qvorum sensis, которая обеспечивает социальное поведение бактерий, до сих пор остаются малоизученными и являются предметом крайне перспективного для медицинской практики научного поиска. В организме человека преимущество такой организации заключается в обеспечении гомеостаза органов, функциональность которых зависит от населяющих их микробов. МИКРОФЛОРА В ОРГАНИЗМЕ ЧЕЛОВЕКА По современным представлениям, основу нормальной микрофлоры человека составляют облигатные анаэробные бактерии, количество которых достигает 1013-1014, что на 1-2 порядка превышает количество эукариотических клеток всех тканей и органов человека вместе взятых [3, 21]. Исследования последних лет показали, что представители нормальной микрофлоры присутствуют в организме человека в виде фиксированных к определенным рецепторам микроколоний, заключенных в биопленку, которая как перчатка, покрывает кожу и слизистые оболочки. Биопленка состоит из экзополисахаридов микробного происхождения, микроколоний и муцина [2]. Функционально биопленка напоминает плаценту. Если плацента регулирует взаимоотношения плода и организма матери, то биопленка выполняет схожую роль, регулируя взаимоотношения между макроорганизмом и окружающей средой. Кроме того, микроорганизмы, входящие в состав биопленок, осуществляют многочисленные метаболические реакции, вовлекаясь в процессы синтеза и деградации как соединений, образуемых в организме хозяина, так и чужеродных субстанций, участвуют в процессах распознавания, абсорбции и транслокации как полезных, так и потенциально вредных агентов [2, 3, 5]. При этом, как в любом микробиоценозе, в биопленках имеются постоянно обитающие виды бактерий (индигенная микрофлора) и транзиторные виды микробов. СОСТАВ КИШЕЧНОГО СОДЕРЖИМОГО В состав кишечного содержимого входят представители 17 семейств, 45 родов и свыше 400 видов микроорганизмов, все они образуют сложнейшую по организации биопленку, и этот факт заставляет нас, например, совершенно по-новому взглянуть на механизм возникновения и причины дисбактериоза кишечника, а также способы его лечения. С этих позиций дисбактериоз нельзя рассматривать как колебания относительного содержания тех или иных видов микроорганизмов. Дисбактериоз кишечника представляет собой кардинальное нарушение строения биопленки слизистой толстого кишечника, а коллективный иммунитет патологической биопленки часто практически сводит на нет возможность коррекции дисбактериозов с помощью пробиотиков (препаратов живых культур основных микроорганизмов кишечника: бифидобактерий, лактобацилл, энтеробактерий и других). Таким образом, для практической медицины преимущество коллективного реагирования имеет и отрицательную сторону. БИОПЛЁНКИ И АНТИБИОТИКИБактерии в биопленках имеют повышенную выживаемость в присутствии агрессивных веществ, факторов иммунной защиты и антибиотиков. Бактерии и грибы в биопленках выживают в присутствии антибиотиков, в частности, биопленки оказались способными выдерживать концентрации антибиотиков в 100-1000 раз больше терапевтических дозировок, подавляющих одиночные бактериальные клетки [10]. Поскольку свободные бактериальные клетки хуже защищены, чем биопленки, то антибиотик, высокоактивный in vitro при тестировании в чистой культуре, при испытаниях in vivo (когда преобладает фенотип биопленок) может оказаться неэффективным. ПРОБЛЕМА ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ В этой связи одной из основных проблем практической медицины становится проблема лечения заболеваний микробного происхождения, в тех случаях, когда чувствительность к антибиотикам микроорганизмов, ассоциированных в биопленку, не соответствует таковой, определенной в лабораторных тестах на клинических изолятах чистых культур бактерий. В связи с этим в последние годы идет активное изучение действия антибиотиков на биопленки бактерий, вызывающих патологические процессы различной локализации. Считается доказанным, что биопленка повышает вирулентность и патогенность всех возбудителей. Подсчитано, что частота инфекций, обусловленных биопленкой, особенно в развитых странах мира, составляет 65%-80% [17]. Многие патогены, такие как E. coli, Salmonella, Yersinia enterocolitica, Listeria, Campylobacter, существуют в форме биопленки на поверхности пищевых продуктов или на поверхности оборудования для их хранения. Кроме того, патогенные бактерии, такие как Staphylococcus aureus, Enterococcus, Streptococcus, E. coli, Klebsiella, Pseudomonas, как правило, растут на катетерах, искусственных суставах, механических клапанах сердца и т.д. [17, 18, 19]. Активность биопленки была зарегистрирована при таких инфекциях, как кариес зубов, кистозный фиброз, инфекции мочевых путей, эндокардит, отит, глазные и раневые инфекции. Продемонстрирована способность H. pylori формировать биопленку на слизистой оболочке желудка и, таким образом, оптимальная антихеликобактерная терапия — это эрадикация биопленки H. Pylori [9, 17, 21, 25]. Возрастающая антибиотико резистентность и развитие бактериальных биопленок являются основными проблемами в лечении инфекций мочевых путей. ПРИЧИНЫ УСТОЙЧИВОСТИ К АНТИБИОТИКАМ В настоящее время идет интенсивное изучение причин такой удивительной устойчивости к антибиотикам у бактерий биопленок. Установлено, что в основе повышенной выживаемости лежат свойства клеток и внеклеточного матрикса. Матрикс биопленки может связывать или не пропускать, и/или инактивировать антибиотики [3, 11, 13]. Устойчивость, обусловленную свойствами клеток биопленки, объясняют уменьшением их свободной поверхности за счет контактов друг с другом и формированием особых бактерий, получивших название персистеров. Персистеры в силу дифференцировки временно становятся устойчивы практически ко всем антибактериальным препаратам [6, 15, 16]. Основными же механизмами повышения устойчивости бактерий к антибиотикам в биопленках являются:
ДВА ТИПА АНТИБИОТИКОВ Исходя из накопившихся данных, следует, что антибиотики по действию на бактерии биопленок разделяются на два типа. К первому относят антибиотики, проникающие в биопленки и угнетающие или убивающие образующие их микроорганизмы. Второй тип — антибиотики, практически не проникающие в биопленки, но эффективно препятствующие их расселению за счет мигрирующих бактерий [2, 11, 16]. Таким образом, некоторые антибиотики не проникают в биопленки и не уничтожают существующие сообщества, а только препятствуют увеличению их числа и распространению в организме человека. В связи с этим в последние годы началось изучение способности антибиотиков проникать в биопленки различных микробов. ПЛОХО ПРОНИКАЮТ Установлено, что в биопленки Klebsiella pneumoniae плохо проникает ампициллин, а в сообщества Enterococcus faecalis — ампициллин, ко-тримаксозол и ванкомицин [8, 14, 15]. В биопленки ряда микробов плохо проникает широко используемый амоксициллин [16]. ХОРОШО ПРОНИКАЮТ К числу антибиотиков, хорошо проникающих через липиды клеток, относятся фторхинолоны. Эта группа антимикробных препаратов способна действовать на основные возбудители урологических заболеваний, в достаточной концентрации проникает в очаг инфекции [9]. Имеющийся опыт использования антибиотиков свидетельствует, что с инфекционным процессом, прежде всего с его клиническими проявлениями, можно справиться с помощью антибиотиков, как проникающих, так и не проникающих в биопленки. Однако разница между ними существует, и она достаточно существенна. Показано, что различия антибиотиков, проникающих и непроникающих в биопленки, могут проявляться в отдаленных результатах лечения. Использование антибиотиков, плохо проникающих в биопленку, очень быстро приводит к формированию и отбору устойчивых штаммов. Кроме того, при этом чаще возникают рецидивы и формируются очаги хронических процессов. СЕГОДНЯ ВАЖНО ЗНАТЬ О СПОСОБНОСТИ ПРОНИКНОВЕНИЯ АНТИБИОТИКА В БИОПЛЁНКУ Таким образом, сейчас очевидно, что повышение эффективности лечения невозможно без тестирования антибиотиков на способность проникать в биопленки, действовать на уже сформированные сообщества и угнетать их образование и расселение. Способность проникать в биопленки и действовать на расположенные внутри и расселяющиеся бактерии является крайне важным свойством антибиотиков, пока, к сожалению, недостаточно исследованным и малоизвестным практическим врачам. Изучена возможность некоторых препаратов, например, кларитромицина, ингибировать образование гликокаликса и его способность в комбинации с цефалоспорином I поколения или ванкомицином препятствовать образованию биопленок на титановом медицинском оборудовании: структура биопленки изменяется, уменьшается количество альгината, гексозы, истончается гликокаликс, тем самым повышается проникновение антимикробного препарата. Проводятся интенсивные исследования по изучению механизмов образования биопленки. Доктор Стэнли-Wall исследовала гены и белки, необходимые для образования биопленки Bacillus subtilis. Она показала, в частности, что возможность образования биопленки определяет белок под названием DegU [25]. Показано, что SasG белок, располагающийся на поверхности Staphylococcusaureus, вместе с ионами цинка, необходим для построения биопленки [27]. РНК связывающий белок CsrA Escherichia coliK-12 может быть, в зависимости от условий культивирования, как стимулятором, так и разрушителем биопленки путем воздействия на внутриклеточный биосинтез гликогена. Белок CsgD E.Coliактивирует рост фимбрий и синтез внеклеточных полисахаридов, способствуя формированию биопленки [28]. Исследователи из Института Пастера в 2010 г. впервые показали, что некоторые вирусы, в частности HTLV-1 ретровирус, способны образовывать комплексы, похожие на бактериальные биопленки. Благодаря биопленке вирусы защищены от иммунной системы, что позволяет им распространяться от клетки к клетке. Изучение образования вирусных биопленок может определить новую терапевтическую стратегию, которая будет ориентирована не только на вирус, а на вирусную биопленку [26]. Представления о биопленках, подтвержденные с помощью современных методов визуализации, изменили взгляды на инфекционные заболевания. Все новые данные свидетельствуют о том, что хронические инфекции принципиально отличаются от острых образованием биопленок, а фагоциты макроорганизма неспособны поглощать биопленки в отличие от отдельных бактериальных клеток [22]. Существование биопленок при хронических инфекциях требует совершенно новых подходов к их диагностике и лечению. Повышает устойчивость биопленок к вредным факторам также присущее им генетическое и фенотипическое разнообразие, которое позволяет им переносить большинство терапевтических воздействий [23]. МЕТОДЫ ВЫЯВЛЕНИЯ БАКТЕРИЙ Традиционные бактериологические методы не выявляют большинство бактерий, участвующих в инфекционном процессе [24]. Новейшие молекулярные, геномные, транскрипционные и протеомные методы позволили определить, что при выделении чистой культуры определяется лишь около 1% клеток патогенного микробиоценоза. В результате лечение нацелено лишь на 1-2 вида бактерий из множества штаммов, присутствующих в составе биопленки (в том числе, возможно, и грибов) [23, 24]. НЕОБХОДИМОСТЬ НОВЫХ МЕТОДОВ ДИАГНОСТИКИ И ЛЕЧЕНИЯ Сейчас не вызывает сомнений необходимость пересмотра концепции патогенеза различных хронических инфекций, внедрив в нее имеющиеся данные о биопленках, что требует использования новых методов диагностики и лечения. Идентифицировать микроорганизмы в составе биопленок позволяют современные молекулярные методы — электрофорез в геле и высокоэффективная жидкостная хроматография с флюоресцентной гибридизацией in situ, эпифлюоресцентная микроскопия, сканирующая электронная микроскопия, конфокальная лазерная сканирующая микроскопия (CLSM), ПЦР с обратной транскриптазой и другие исследования [7]. Терапевтическое воздействие на биопленки может быть направлено на механизмы первоначальной адгезии бактерий к поверхности, блокирование синтеза или разрушение полимерного матрикса, нарушение межклеточного обмена информацией, а также оно может сочетаться с собственно бактерицидными агентами. Подобное лечение, действующее на структуру или функции биопленок, может оказаться более эффективным, чем стандартная антибактериальная терапия [4]. Таким образом, лечение хронических инфекций в настоящее время уже не может основываться на традиционной концепции микробиологии. Новые представления о биопленках требуют изменения подходов к диагностике и лечению инфекций в самых различных областях медицины. С.В. Мальцев, Г.Ш. Мансурова Казанская государственная медицинская академия Мальцев Станислав Викторович — доктор медицинских наук, профессор, заведующий кафедрой педиатрии с курсом поликлинической педиатрии
Литература: 1. Watnick P., Kolter R., Biofilm, city of microbes. J Bacteriol 2000; 182: 2675-9. 2. Тец В.В. Бактериальные сообщества. В кн.: Клеточные сообщества / под ред. В. Теца. —Санкт-Петербург: Изд-во СПбГМУ, 1998. — С. 15-73. 3. Costerton J.W., Stewart P.S., Greenberg E.P. Bacterial biofilms: a common cause of persistent infections. Science 1999; 284: 1318-22. 4. Costerton W., Veeh R, Shirtliff M et al. The application of biofilm science to the study and control of chronic bacterial infections. Clin. Invest 2003; 112:1466-77. 5. O’Toolе G.A., Kaplan H.B., Kolter R. Biofilm formation as microbial development. Ann Rev Microbiol 2000; 54: 49-79. 6. Tetz V.V. The effect of antimicrobial agents and mutagen on bacterial cells in colonies. Med Microbiol. Lett., 1996; 5:426-36. 7. Tetz V.V. et al. Extracellular phospholipids of isolated bacterial communities. Biofilms, 2004; 1:149-55. 8. Sponza D.T. Investigation of extracellular polymer substances (EPS) and physicochemical properties of different activated sludge flocs under steady-state conditions. Enzyme Microb Technol, 2003; 32: 375-85. 9. В.В. Тец, Н.К. Артеменко. Биопленки возбудителей уроинфекций и использование фторхинолонов. Consilium Medicum. — Урология, 2008. — Т. 10. — № 4. 10. El-Azizi M. et al. //Ann. Clin. Microbiol. Antimicrob. 2005. V. 4. P. 2. 11. Davies D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov 2003; 2: 114-22. 12. Campanac C., Pineau L., Payard A., Baziard-Mouysset G., Roques C. Interactions between Biocide Cationic Agents and Bacterial Biofilms. Antimicrob Agents, Chemother 2002; 46: 1469-74. 13. Chambless J.D., Hunt S.M., Philip S.S. A three-dimensional computer model of four hypothetical mechanisms protecting biofilms from antimicrobials Appl. and Environmental Microbiology, 2006; 72: 2005-13. 14. Harrison J.J., Ceri H., Roper N.J., Badry E.A. et al. Persister Cells mediate tolerance to metal oxyanions in Escherichia coli. Microbiology. 2005; 151: 3181-95. 15. Shah K.D., Spoering A.N., Lewis K.K. Specialized persister cells and the mechanism of multidrug tolerance in Escherichia coli. J Bacteriol 2004; 186: 8172-80. 16. Sandoe J. et al. Measurement of ampicillin, vancomycin, linezolid and gentamicin activity against enterococcal biofilms, Journal of Antimicrobial Chemotherapy, 2006; 57: 767-70. 17. Hancock V., Ferrieres L., Klemm P. Biofilm formation by asymptomatic and virulent urinary tract infectious Escherichia coli strains. FEMS Immunol. Med. Microbiol. 2007; 51: 212-9. 18. Tenke P., Kovacs B., Jackel M., Nagy E. The role of biofilm infection in urology. World Journal of Urology, 2006; 24: 13-20. 19. Trautner B.W., Darouiche R.O. Role of biofilm in catheter-associated urinary tract infection. American Journal of Infection Control 2004; 32: 177-83. 20. Ryder M.A. Catheter-Related Infections: It’s All About Biofilm. Topics in Advanced Practice Nursing eJournal. 2005; 5 (3). 21. Hunt S.M. et al. Hypothesis for the role of nutrient starvation in biofilm detachment. Appl Environ Microbiol, 2004; 70: 7418-25. 22. Wolcott R.D., Ehrlich G.D. // JAMA. 2008. V. 299. P. 2682. 23. Ehrlich G.D. et al. // Clin. Orthop. Relat. Res. 2005. V. 437. P. 20. 24. Dowd S.E. et al. // BMC Microbiol. 2008. V. 8. P. 43. 25. Genes That Make Bacteria Make Up Their Minds, ScienceDaily, Apr., 6, 2009. 26. Biofilms: Discovery of a New Mechanism of Virus Propagation, ScienceDaily, 2010, Feb., 8. 27. Joan A. Geoghegan et al. Role of Surface Protein SasG in Biofilm Formation by Staphylococcus aureus. Journal of Bacteriology, Nov., 2010, V. 192, No. 21, P. 5663-5673. 28. Debra W. Jackson et al. Biofilm Formation and Dispersal under the Influence of the Global Regulator CsrA ofEscherichia coli, Journal of Bacteriology, Jan., 2002, V. 184, No.1, P. 290-301.
Источник <http://pmarchive.ru/chto-takoe-bioplenka/>
|
| Технология «Сайт-Менеджер » |